El hombre, a través de sus actividades, perturba el medio ambiente e interfiere en la precipitación de dos maneras fundamentales: con la construcción de ciudades y con el vertido de contaminantes a la atmósfera. Respecto a la contaminación atmosférica, uno de sus efectos más destructivos es la lluvia ácida, así denominada por la elevada acidez del agua precipitada
La lluvia acida es un problema ecológico que no respeta fronteras. La contaminación atmosférica que la causa es arrastrada por los vientos dominantes, desde las zonas industriales hasta montañas, lagos y bosques. Ni siquiera el Ártico está libre de tal contaminación.
¿De dónde proviene el ácido? Ya no hay duda de que la mayor parte se origina en automóviles, hogares, fábricas y plantas de energía. Siempre ha existido un poco de ácido en la lluvia alimentada por volcanes, pantanos y el plancton de los océanos; pero los científicos saben que ha aumentado abruptamente en los últimos 200 años. El hielo formado antes de la Revolución Industrial y atrapado en los glaciares resultó tener una acidez moderada, de origen natural.
La lluvia se vuelve acida principalmente por la presencia de dos elementos químicos: azufre y nitrógeno. El azufre se encuentra en la hulla y el petróleo. Al quemarse forma bióxido de azufre, que se mezcla con las gotas de agua en las nubes y se convierte en ácido sulfúrico. Como resultado de la combustión, el nitrógeno forma óxidos que se transforman en ácido nítrico al reaccionar con las moléculas de agua. Una parte de ambos ácidos cae donde se originan, mientras que el resto puede recorrer cientos de kilómetros.
La acidez de las precipitaciones está determinada por la concentración de iones de hidrógeno presentes en el agua; se expresa en términos de valor del pH, según una escala de O a 14, donde el valor 7 indica solución neutra (el agua destilada, por ejemplo), los valores inferiores, soluciones ácidas (manzanas, vinagre, zumo de limón), y los superiores, soluciones básicas (lejía, cal, amoniaco). Cada descenso del. pH en una unidad supone un aumento diez veces mayor en la acidez.
La lluvia ya es de por sí ligeramente ácida, pues contiene dióxido de carbono (también lo son la nieve, la niebla y las formaciones de hielo). Se considera lluvia ácida aquella que tiene un pH inferior a 5,6.
Existen diversas fuentes naturales de lluvia ácida: entre otras, los compuestos de azufre que resultan de las erupciones volcánicas, los manantiales termales y las fumarolas, y una cantidad considerable de óxidos de nitrógeno y azufre, producto final del metabolismo de diversos grupos bacterianos. A pesar de estos contaminantes naturales del aire, el pH del hielo glacial llega a casi 5,0, lo que significa que las emisiones naturales de los compuestos ácidos no son el origen principal de la lluvia ácida, sino las actividades de las sociedades humanas, .especialmente las más desarrolladas.
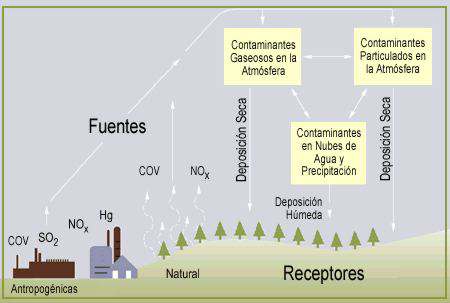
La combustión de carburantes fósiles
La combustión de carburantes fósiles (petróleo, gas y carbón) por fábricas, centrales eléctricas, hogares y vehículos libera dióxido de azufre y óxidos de nitrógeno. Estos’ gases no sólo ejercen un efecto nocivo sobre las cosechas, los árboles y los edificios del entorno más inmediato, sino que atraviesan largos recorridos transportados por el viento. Durante el trayecto, los rayos solares los transforman en sulfatos y nitratos. Una vez secos, estos contaminantes se resisten a caer al suelo, y tan sólo la lluvia y la nieve logran extraerlos de la atmósfera. Así, son absorbidos por las nubes y convertidos en ácido sulfúrico y nítrico, ambos solubles en agua, que se depositan a continuación, disueltos en la lluvia, la nieve o la niebla, sobre las plantas, los árboles, los lagos y los ríos, los mares y los suelos.
Efectos de la lluvia ácida sobre el terreno, las aguas dulces y el medio urbano
El fenómeno de la lluvia ácida (incluida también la nieve, las nieblas y los rocíos ácidos) tiene consecuencias negativas sobre el medio ambiente, porque no sólo afecta a la calidad del agua, sino también a los suelos, a los ecosistemas y, de modo particular a la vegetación: bastan 0,01-0,02 ppm de ácido (que corresponden a 10-20 mm./m3 en la atmósfera) para matar los líquenes; por su parte, las coníferas no sobreviven a concentraciones mayores de 0,07-0,08 ppm.
Los efectos de la lluvia ácida sobre el terreno dependen en gran medida del tipo de suelo sobre el que se deposita. Si el terreno es una formación de origen calcáreo, ¡os ácidos serán rápidamente absorbidos por el carbonato cálcico que compone esta clase de suelos. Por el contrario, si la superficie de depósito es de composición arcillosa o granítica, las consecuencias son más graves, dado el enorme poder de disolución que tiene este tipo de agua de lluvia, que acaba alterando el pH medio del terreno1 originando una acidificación general. Al filtrarse en la tierra, los ácidos destruyen los nutrientes esenciales del suelo, tales como el magnesio, el calcio y el potasio, que alimentan a las plantas y los árboles. estos se vuelven ralos y descoloridos, y mueren.
Las regiones montañosas sometidas a precipitaciones de lluvia o nieve ácidas están, a menudo, compuestas por granito y otras rocas ígneas, que producen suelos delgados carentes de los agentes químicos capaces de neutralizar los ácidos presentes en esta clase de precipitaciones.
Otro efecto de la lluvia ácida es el aumento de la acidez en las aguas dulces, como consecuencia del incremento de metales pesados muy tóxicos (plomo, aluminio, mercurio, cinc y manganeso), que provocan la ruptura de las cadenas tróficas y del proceso reproductivo de los peces, condenando a los ríos y lagos a una lenta pero implacable disminución de su fauna. Los lagos tienen un pH casi neutro, debido a que minerales como el calcio, liberados en sus aguas a través del suelo, neutralizan la lluvia natural. Sin embargo, este mecanismo amortiguador puede no ser suficiente para absorber el incremento de acidez de aquélla.
Los efectos de la lluvia ácida sobre el medio urbano son, por una parte, la corrosión de edificios, la degradación de las piedras de las catedrales y otros monumentos históricos y, por otra, las afecciones del aparato respiratorio en los seres humanos.
Las regiones del mundo que más sufren los efectos de la lluvia ácida son aquellas dotadas de suelos sensibles, esto es, que carecen del porcentaje necesario de neutralizantes, sobre todo en áreas situadas dentro o cerca de grandes agentes contaminantes. También en ámbitos no industrializados, como áreas remotas de China, donde el carbón se utiliza para calefacción, cocina y depuración de agua, o en zonas de África donde se queman arbustos para propiciar el crecimiento de los pastos, se producen los mismos efectos.
Los contaminantes atraviesan largos recorridos transportados por el viento
En virtud de los desplazamientos de las masas de aire, los contaminantes alcanzan zonas alejadas cientos de kilómetros del lugar donde han sido emitidos. Por esta razón, surge la necesidad de saber hacia dónde se dirigen las nubes contaminantes originadas en un país. Se han elaborado con este fin programas modelo, aplicados a distancias variables, que contemplan: ciclos convectivos, lluvias, nubes y el efecto del suelo. Pronostican variables de vientos, temperatura del aire, humedad relativa, superficie del mar, diferencias de presiones, etc.
Los métodos normalizados más empleados en el análisis de SO2 son los siguientes: método del peróxido de hidrógeno, método del yodo, método gravimétrico, método yodo-tiosulfato, métodos espectrofotométricos, métodos calorimétricos, etc. Se ha podido constatar, por un lado, que Gran Bretaña y Alemania son los grandes exportadores de SO2, al provocar lluvias ácidas en otros países de la UE. Por otro lado, se sabe que la acidez de las lluvias, en general, es mayor en los meses de primavera y verano, y no coinciden estas épocas con los meses en los cuales las cantidades emitidas de contaminantes son mayores (meses de invierno). Por último, también se ha comprobado que el transporte de contaminantes por las corrientes de aire es muy importante, ya que los efectos de lluvia ácida que sufre un país se deben, en su mayor parte, a las emisiones provocadas por otros países.
La lucha contra la lluvia ácida
Desde los años ochenta, se ha producido una toma de conciencia sobre la necesidad de controlar y paliar, en la medida de lo posible, los efectos perniciosos que sobre el medio natural ejercen las sociedades humanas. Las inversiones se han concentrado en impulsar el desarrollo de las llamadas energías limpias (solar y eólica, fundamentalmente), y la implantación de controles más rigurosos para limitar la liberación a la atmósfera de agentes contaminantes.
Los países industrializados han movilizado gran cantidad de recursos económicos para reducir ¡as emisiones ácidas. En 1993, la UE acordó reducir las emisiones de óxidos de azufre en un 40% para el año 1998 y en un 60% para el 2003, y las de óxidos nitrosos, en un 30% para 1998. Otra de las medidas acordadas a partir del año 1993 fue la de instalar catalizadores en los coches de nueva fabricación, para conseguir la reducción de las emisiones de los mencionados gases. Uno de los progresos más significativos ha tenido lugar en las cámaras de producción de las centrales termoeléctricas, un causante esencial de las emisiones de ácidos a la atmósfera: se han incorporado técnicas que reducen e incluso eliminan la emisión de los óxidos de nitrógeno y azufre, que son recuperados y reutilizados como abono.
COMO SE MIDE LA ACIDEZ
Los ácidos destruyen casi todo lo que alcanzan; son solubles en agua y su fuerza se mide por el pH (potencial de nitrógeno). La escala del pH abarca valores desde 1 hasta 14. El 1 indica acidez extrema y el 7 neutralidad; el 14 se da en líquidos de gran alcalinidad (lo opuesto a la acidez). El pH se determina con un medidor especial o papel indicador. Un ácido fuerte como el sulfúrico hace que el papel se coloree de rojo, uno neutro lo pone verde, y los líquidos muy alcalinas le dan una coloración púrpura.
Los ácidos destruyen casi todo lo que alcanzan; son solubles en agua y su fuerza se mide por el pH (potencial de nitrógeno). La escala del pH abarca valores desde 1 hasta 14. El 1 indica acidez extrema y el 7 neutralidad; el 14 se da en líquidos de gran alcalinidad (lo opuesto a la acidez). El pH se determina con un medidor especial o papel indicador. Un ácido fuerte como el sulfúrico hace que el papel se coloree de rojo, uno neutro lo pone verde, y los líquidos muy alcalinas le dan una coloración púrpura.
| LIQUIDO | COLOR DEL INDICADOR | PH |
| Acido Sulfúrico Concentrado | Rojo | 1.0 |
| Jugo de Limón | Rojo | 2.3 |
| Vinagre | Rosa | 3.3 |
| Lluvia Zonas Industriales | Rosa | 4.3 |
| Lluvia Normal | Naranja | 5.5 |
| Lluvia Destilada | Verde | 7.0 |
Fuente Consultada: Gran Enciclopedia Universal (Cap. 23)








No hay comentarios.: